手性固定相系列介绍(三)——蛋白质类
手性固定相在高效液相色谱(HPLC)中扮演着实现对映体拆分的关键角色。其中,蛋白质类手性固定相因其独特的性质而备受关注。今天小研带大家一起来了解一下这类独特的蛋白质类手性固定相~
蛋白质(protein)根据20种氨基酸侧链R基团的极性,可将其分为非极性R基氨基酸(8种)、不带电荷的极性R基氨基酸(7种)、带负电荷的R基氨基酸(2种)和带正电荷的R基氨基酸(3种)。
自然界的生命存在于由生物大分子组成的手性环境中,酶和受体系统总是显示出对映体选择性或立体选择性。蛋白质是一类复杂的高分子聚合物,所含亚单位L-氨基酸具有手性特异性,能特异性地结合小分子,因此对手性分子具有很强的识别能力。然而,只有有限的一些蛋白质被系统研究而被制备成手性固定相。
目前,用于手性拆分的蛋白质按其来源可分为:
白蛋白类:包括牛血清蛋白(BSA)和人血清白蛋白(HSA);
1.1 牛血清蛋白(BSA)
牛血清蛋白
牛血清蛋白(BSA)是球状蛋白,由581个氨基酸组成的单链,链内有17个二硫桥键,分子量为66210,分子量较小、溶解性较大、稳定性较好、和各种配体的亲合性较好、易于分离提纯和大量制备;更为重要的是牛血清蛋白具有对某些氨基酸衍生物和药物异构体可提供手性位点,手性药物对映异构体与手性位点可能产生不同作用力,如氢键疏水效应和静电作用等,进而实现对映体拆分,从而被用于HPLC手性分离。
以广州研创独家专利产品——EnantioPak® BSA牛血清蛋白手性色谱柱为例,它是反相专用柱,其固定相是牛血清蛋白,适用于水溶性化合物、氨基酸类、伯胺类的测定。
EnantioPak® BSA也是甲氨蝶呤的专用柱,根据《中国药典2020年版》中甲氨蝶呤的检测方法,用牛血清蛋白手性色谱柱可检测其光学纯度,使用广州研创EnantioPak® BSA按照高效液相色谱法做了全面的验证,在标准条件下,可满足检测要求。
色谱条件 色谱柱:广州研创EnantioPak®BSA ,4.6×150mm,5μm 色谱图及样品测定结果
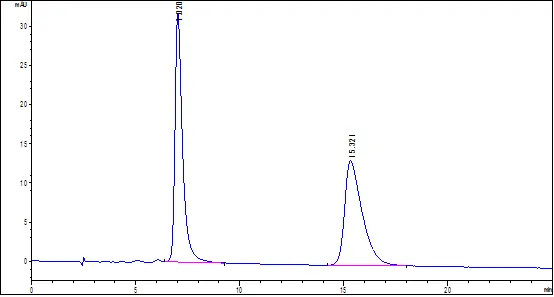
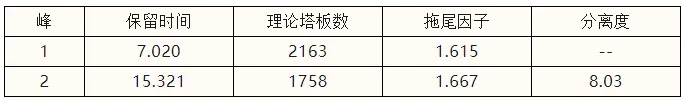
甲氨蝶呤图谱
广州研创专利的这款EnantioPak® BSA牛血清蛋白柱除了可以用于检测甲氨蝶呤,还可用于拆分酒石酸盐、磷酸奥硝唑酯二钠、甲基四氢叶酸钙、匹多莫德、色氨酸、磷酸特地唑胺、恶唑烷酮类抗菌剂等等。目前主要有分析柱及保护柱,可以去根据实验要求去选择。(详情请咨询18922204815)
1.2人血清白蛋白(HSA)
人血清白蛋白(HSA)与 BSA 的性质非常相似,HSA 也是一种球状蛋白,分子量为 66437,等电点为4.7,它是一条含有17个链内二硫键的单肽链。它能拆分一些弱酸或中性化合物的对映异构体,其中包括芳基丙酸类非甾体抗炎类药物,还原叶酸如亚叶酸5-甲基四氢叶酸,苯并二氮草如去甲羟基安定、羟基安定和劳拉西泮。
②糖蛋白类:包括α1-酸性糖蛋白(α1-AGP)、卵类黏蛋白(OVM)和卵蛋白(AVI)、黄素蛋白(FP);
2.1α1-酸性糖蛋白(α1-AGP)
α1-酸性糖蛋白是由181个氨基酸和5个杂多糖组成的单链多肽,包含14个唾液酸残基,平均分子量为33000,糖含量约34%。因其较低的等电点(pl 2.7),成为结合阳离子药物的主要血浆蛋白。许多碱性、中性和酸性对映体都能在AGP柱上得到拆分。
2.2卵类黏蛋白(OVM)
卵类粘蛋白也被用作手性固定相。鸡卵类黏蛋白作为蛋白质手性固定相可以拆分药物和体液中的酸、碱、中性对映异构体化合物。该柱的稳定性优于其他蛋白质类手性固定相。
③酶类:包括纤维素酶、胰蛋白酶、α-胰凝乳蛋白酶、葡聚糖纤维二糖水解酶(CBH)、胃蛋白酶、淀粉葡萄糖苷酶、溶菌酶;
3.1纤维素酶
纤维素酶是具有不同的结构但都具有水解1,4-糖苷键功能的一组酶家族。由真菌瑞氏木霉产生的纤维素酶 CBH I和CBH II 为酸糖蛋白。CBH I固定相能拆分酸性、碱性及不带电荷的消旋体,对于拆分受体阻断剂选择性尤其高。而CBH II对β-受体阻断剂选择性不如CBH I,但能拆分其他的消旋体。
3.2胰蛋白酶和α-胰凝乳蛋白酶
两者都属丝氨酸蛋白酶家族、催化氨基化合物和脂类对映体的选择性水解。胰蛋白酶固定相能拆分O-和N,O-衍生化的氢基酸,这两类氨基酸都是该酶的底物,手性识别位点也正位于酶的活性中心,这提示立体选择性拆分是酶的活性作用的结果。α-凝乳蛋白酶 固定相能拆分氨基酸、氨基酸生生物、二肽及其他的一些化合物如萘普生和芳氧基丙酸类。
3.3淀粉葡萄糖苷酶
淀粉葡萄糖苷酶能对几种β-受体阻断剂的消旋体进行拆分,流动相pH>6有助于提高拆分选择性。
3.4胃蛋白酶和溶菌酶
这两种蛋白的固定相均能拆分碱性和不带电的对映体,但不能拆分酸性对映体。当流动相pH>7时,胃蛋白酶柱会失去手性识别特性并发生不可逆性的变性。
④其他蛋白:卵传铁蛋白和β-乳球蛋白。
多数蛋白质类手性固定相的分离机制目前尚不十分清楚,但是蛋白质类手性固定相的手性识别能力可以归结为它们独特的一、二和三级结构特征。尤其是在对映体的手性识别过程中,三级结构所创造的疏水性口袋、沟槽或通道对非对映络合物的形成常常是十分重要的。
蛋白质类手性固定相的作用机制主要是通过疏水和极性相互作用进行手性拆分。当对映体进入色谱柱后,它们会与固定相上的蛋白质发生相互作用。由于蛋白质的手性识别能力,不同的对映体会与蛋白质形成不同的结合方式和强度,从而实现手性拆分。
蛋白质类手性固定相的制备方法有两种:一种是物理吸附法,即通过物理方法将蛋白质吸附于色谱基质上;另一种是化学键合法,即蛋白质以共价键的方式固定到色谱基质上。 物理吸附法的缺点是可能会导致蛋白质在基质上发生多层吸附,同时在使用过程中蛋白质容易流失。 键合型手性固定相中蛋白质于基质有琼脂糖、硅胶及聚合物等,其中硅胶最为常用。硅胶基质的缺点是只能在pH=2~8的范围内使用,在强酸或强碱的情况下蛋白质也会失活。 蛋白质通常通过自己的氨基或羧基共价键合到已经衍生化的硅胶颗粒上,下面是典型的蛋白质手性固定相键合的制备方法。 图 利用氨丙基-硅胶键合蛋白质 方法如上图:包括多孔氨丙基硅胶通过 N,N'-二琥珀酰亚胺基碳酸盐(DSC)活化,促使蛋白质的键合。氨丙基硅胶也可用N,N'-二琥珀酰亚胺基辛二酸盐活化(DSS)。蛋白质键合到 DSC活化的氨丙基硅胶上是通过一个脲键,间隔臂CH2,链可以同溶质产生疏水作用而产生低的对映异构体识别,通过增加配体的弹性和适应性可增加蛋白质手性固定相的对映异构体选择性。 除了上面这种方法外键合型的还有利用缩水甘油基丙基硅胶键合蛋白质等其它制备方法,可以依据自己的实验需求去选择。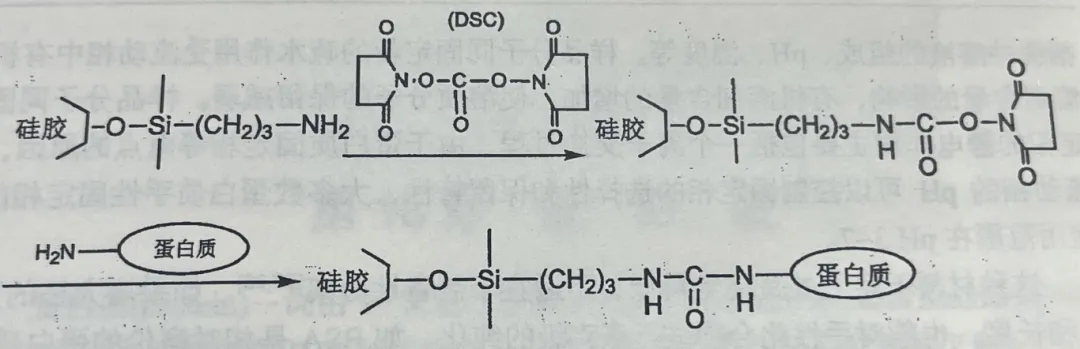
蛋白质的空间结构在很大程度上影响其立体选择性,因而其固定化状况极大地影响手性药物的拆分。同时由于蛋白质易变性,通常只能用温和的水相缓冲液作流动相,对柱温也有一定的要求。
1.固定化状况
固定化方法、载体的物理性质、键合反应基团的空间长度、键合到柱载体上的蛋白质的量以及蛋白质提取和纯化方法等均影响固定相的手性选择性。蛋白质固定化方法可影响蛋白质提供的手性识别位点,并使其与对映体间产生不同的疏水作用。如将BSA 键合到硅胶上比吸附到硅胶上更具手性选择性。载体硅胶的孔径、键合反应基团的空间长度会直接影响键合到柱载体上的蛋白质的量,可能导致不同程度的手性或非手性作用其中手性作用源于蛋白质提供的手性识别位点,非手性作用来自于未被覆盖的载体基团。
2.流动相的pH值
流动相的pH值是一个最重要的参数,它不仅决定了溶质的电离程度,同时会改变蛋白质分子的三维结构影响其亲和性和手性特性。若溶质离子化程度减少,与固定相的亲和力就会增加保留值增加。
3.有机改性剂
在流动相中加入少量改性剂能影响溶质在柱上保留行为和手性作用,这是改性剂和溶质竞争固定相上键结合位点或者改变蛋白质疏水性的结果。常用的改性剂可分为四类:中性有机改性剂,如乙醇、丙醇、乙腈等阳离子有机改性剂。
4.色谱柱温度
升高柱温可增加理论塔板数,改善柱效。但同时,柱温变化可改变离子平衡状况,如改变溶质的电离状态、导致蛋白质固定相结构改变等,最终改变溶质同固定相的手性作用力。
下期预告:刷型手性固定相,敬请期待~


 地址:广州市黄埔区揽月路3号国际企业孵化器F座310
地址:广州市黄埔区揽月路3号国际企业孵化器F座310 电话:18922204815
电话:18922204815  传真:020-84418344
传真:020-84418344 邮箱:mzzhang@chiral-se.com
邮箱:mzzhang@chiral-se.com

