前沿 | 破解「阿米卡星未知杂质」之谜
#01 引言
继上一篇《氨基糖苷类抗生素-阿米卡星杂质稳定性研究分享》之后,今天我们来分享下阿米卡星的4个未知降解杂质的发现与研发过程。
#02 发现
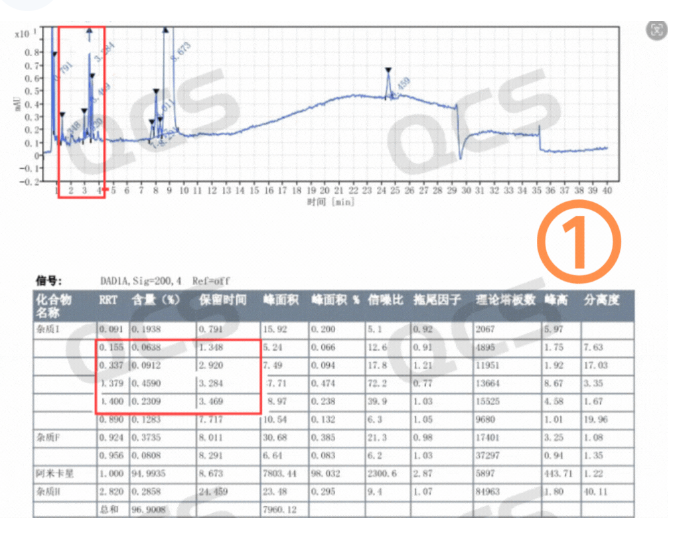
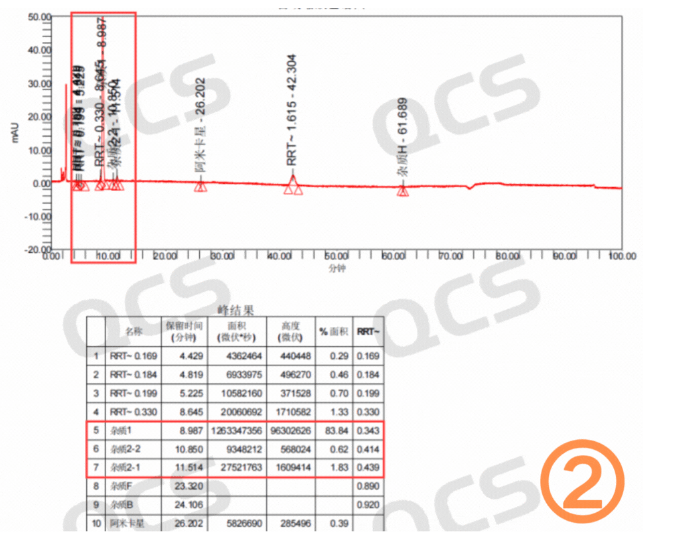
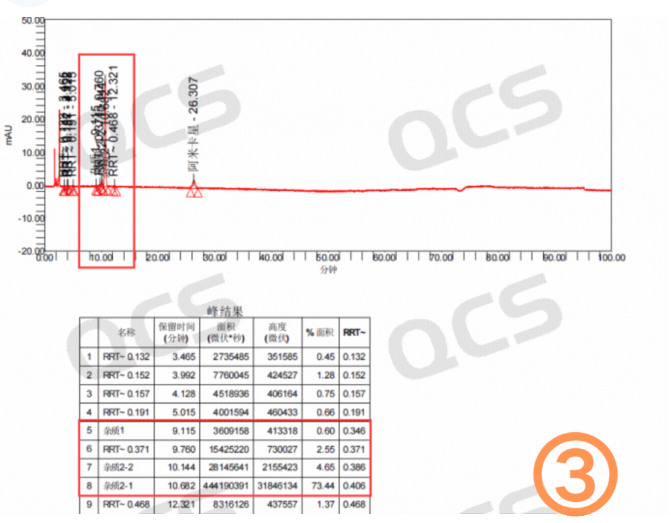
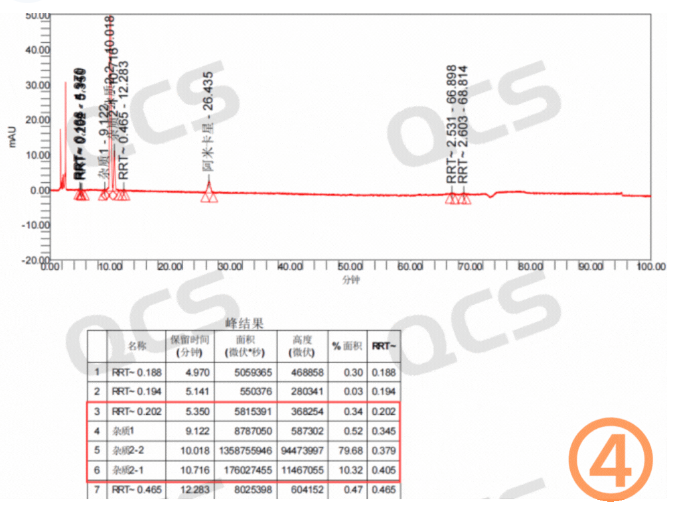
图1:客户粗品图(四图)
(硫酸)阿米卡星是氨基糖苷类抗生素,算是一个比较老的品种了。但是从目前市场反馈看,生产的厂家不在少数。最近我们接到多个客户反馈其阿米卡星产品在长期稳定性研究过程中产生了4个未知大杂质。这些杂质保留时间主要集中在4-10分钟之间,以相对保留时间(RRT)计算分别为:0.18~0.2(未知杂质1),0.35~0.36(未知杂质2),0.37~0.38(未知杂质3),0.4~0.42(未知杂质4)区间。具体的杂质信息数据汇总见图2:
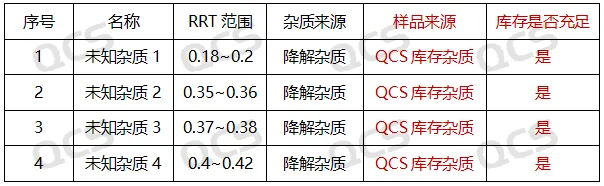
图2:四个未知杂质的相关信息数据汇总
根据已有信息可以判断以上杂质并不是药典收录的已知结构杂质,但是通过检索相关的文献和药典资料,我们发现以上杂质信号在欧洲药典(EP)典型色谱图或系统适用性图谱中均有对应信号出现,但是该杂质信号未被欧洲药典明确鉴定如图3所示:
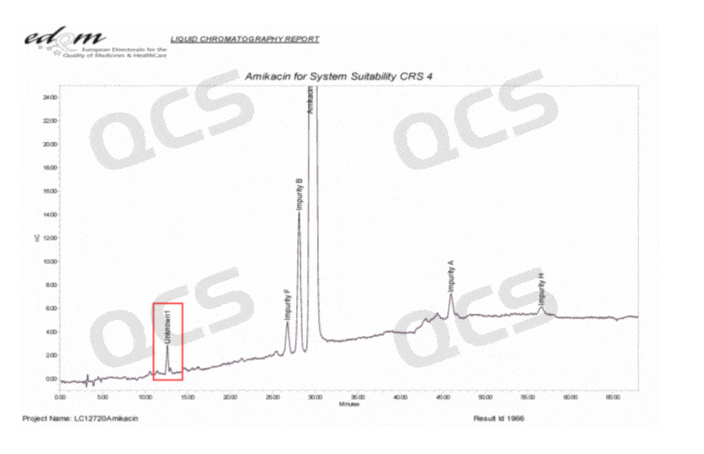
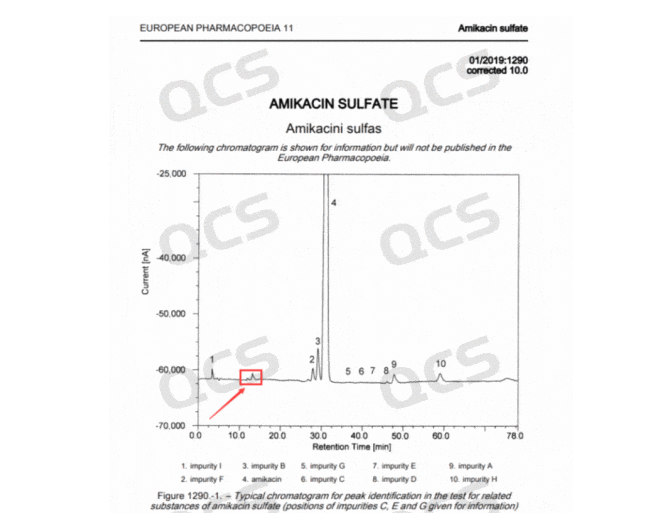
图3:欧洲药典色谱图信息(两图)
#03杂质的制备和纯化
针对欧洲药典中未充分表征但实际样品中出现的杂质研究需求,我中心进行了专项开发。针对客户对阿米卡星未知杂质研究的需求,我中心首先依托制备分离部门对含目标杂质的粗品开展了制备纯化工作。
从粗品图就可以看到四个未知杂质保留时间较小并且出峰时间差异较小,同时该条件下阿米卡星的检测条件里面又有非常多的盐会对杂质的制备产生很大影响。QCS标准物质研发中心制备分离实验室投入四个多月时间进行了制备方法的开发和优化,最终实现了目标杂质的良好分离。在整个开发与生产过程中主要面临以下四大难题:
第一:阿米卡星极性过大,且四个目标杂质保留时间过小,需要单独开发分析和制备方法。
第二:四个目标杂质杂质挨得太近,只有接近阿米卡星标准分析方法(100min/针)的分离条件才能有效的分离开这四个杂质,所以制备过程中面临很大技术挑战,最终优化后的制备方法所需时间达到120min/针。
第三:由于目标杂质峰分离度较差,所以单针进样量非常小,不到20mg/针,产品的富集周期远远超出我们的预期(120min/针,一天八小时只能进4针,单日粗品进样量不到100mg),同时粗品很难一次性纯化干净,往往需要多次制备。
第四:由于产品分析方法中用了大量的盐,提纯后的产品溶液含有盐,除盐也成了一个非常艰巨的任务。
#04杂质的研究
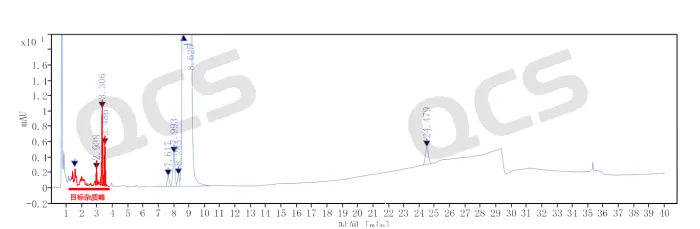
最终经过制备同事的不断努力和辛苦付出,克服以上各种难题,我们终于制备分离得到了四个未知降解杂质样品。分析同事按照药典方法分别对四个杂质做了鉴定,并分别完成了阿米卡星API与四个未知杂质的单独1:1混样以及四个未知杂质和API的整体混合大混样。现分享一下阿米卡星API+未知杂质1+未知杂质2+未知杂质3+未知杂质4的总混合进样数据,见图4:
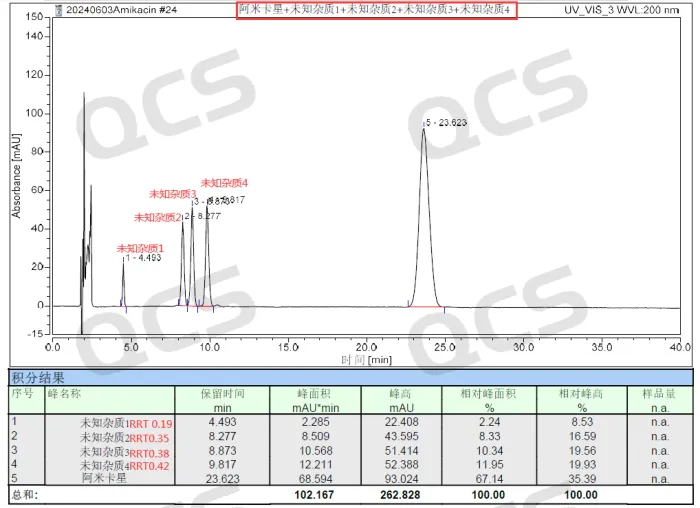
图4:四个未知杂质和阿米卡星的混合进样数据
最后,我中心已基本完成了对阿米卡星降解杂质的相关研究,以上未知杂质已经可以提供相关产品,欢迎感兴趣的客户过来咨询和沟通。
#05分享获取干货福利
尽管阿米卡星是个很老的品种了,研究的客户不在少数,但目前市场上的客户基本上都在反馈阿米卡星杂质B和杂质G在标准条件下的检测时间是反过来的,杂质B在主峰后面杂质G在前面与EP的典型色谱图或者系统适用性图谱相悖,很多客户质疑产品的正确性,但是目前并未检索到官方勘误之类的资料,下期我们将重点分享阿米卡星EP杂质BG的相关研究,欢迎大家积极参与讨论。


 地址:广州市黄埔区揽月路3号国际企业孵化器F座310
地址:广州市黄埔区揽月路3号国际企业孵化器F座310 电话:18922204815
电话:18922204815  传真:020-84418344
传真:020-84418344 邮箱:mzzhang@chiral-se.com
邮箱:mzzhang@chiral-se.com

